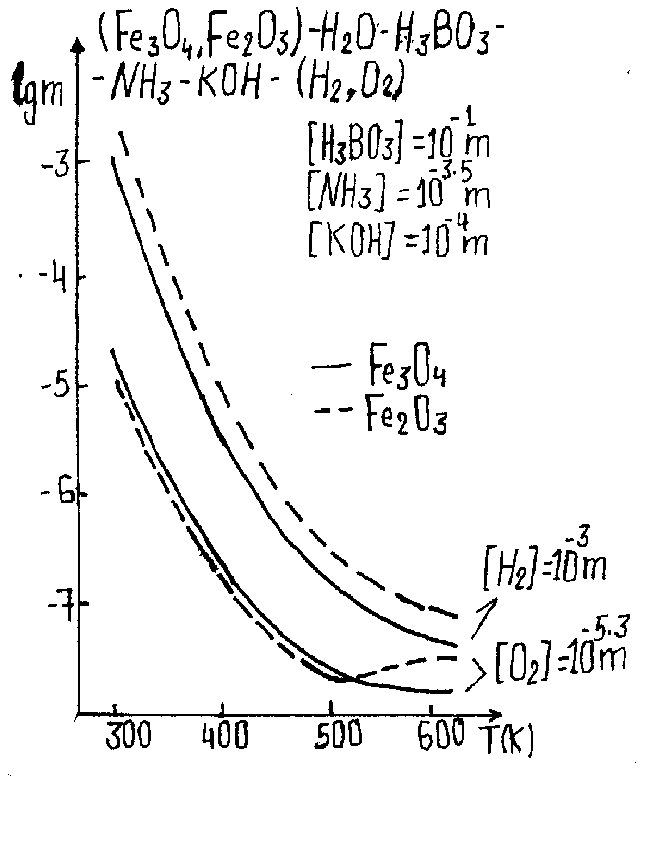|
Санкт-Петербург ул. Парфеновская д. 9к1 +7 (812) 716-23-19 |
|
|  Разработанный нами метод термодинамического моделирования многокомпонентных систем в широкой области параметров состояния позволяет глубже изучить протекание различных процессов. |
|
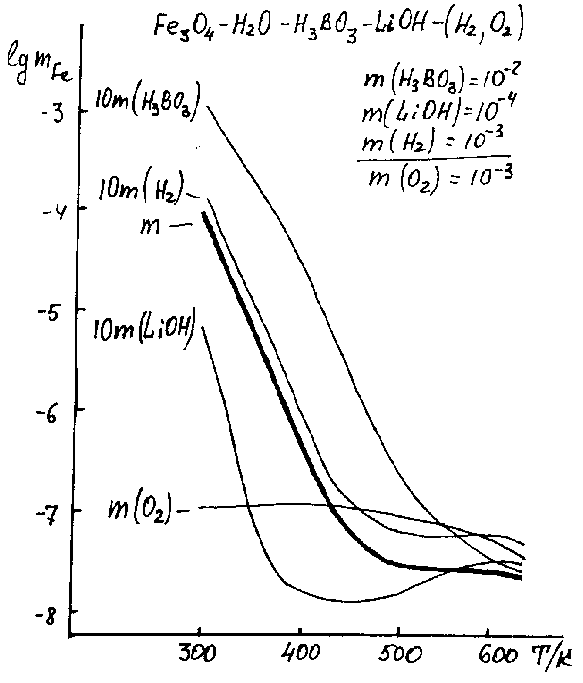
Исследование водных систем теплоносителей ядерных энергетических установок (ЯЭУ).Проблемы оптимизации водно-химических режимов (ВХР), надежности и безопасности работы ЯЭУ требуют определения основных продуктов коррозии, образующихся на поверхности оборудования водного тракта, их растворимости, влияния температуры, нормируемых параметров и др. Исследования проводились с использованием программного комплекса для термодинамического моделирования и расчета химических и фазовых превращений. Заказчик: Ленинградская атомная электростанция (ЛАЭС) Цель работы. Увеличение надежности эксплуатации систем теплоносителей ЯЭУ. Порядок работы. Было проведено исследование водного теплоносителя в условиях тракта (основной конструкционный материал — сплавы на основе железа) 1-го контура ЯЭУ с реакторами типа ВВЭР (отечественные) и PWR (зарубежные аналоги), которые описываются соответственно системами: Fe - H2O - H3BO3 - KOH - (H2, O2) - NH3 Термодинамическое моделирование системы проводилось в расширенной (по сравнению с регламентом) температурно-концентрационной области: H3BO3 — до 1 m, температуры от 25 до 350 С. Во-первых, оказалось, что ключевые особенности поведения этих систем схожи и, в частности, основным ПК железа в регламентируемых условиях для них является магнетит Fe3O4. Лишь в существенно окислительной среде более устойчив оксид железа(III) — гематит Fe2O3. Эти результаты, отметим, не только полностью подтверждаются независимыми экспериментальными и эксплуатационными данными, но количественно и более детально уточняют их. Поэтому основная задача здесь — исследование взаимодействия Fe3O4 с теплоносителем в восстановительных условиях и Fe2O3 — в окислительных. Общее представление о влиянии каждого из параметров состояния борнолитиевой системы на растворимость магнетита дают данные рис.1, где представлены температурные зависимости растворимости не только для регламентируемого раствора, но и для случаев независимого отклонения (увеличения на порядок) концентраций каждого из растворенных компонентов — H3BO3, LiOH, H2; а также для окислительных (O2) условий. Рисунок 1. Влияние концентраций компонентов раствора на температурные зависимости растворимости магнетита.
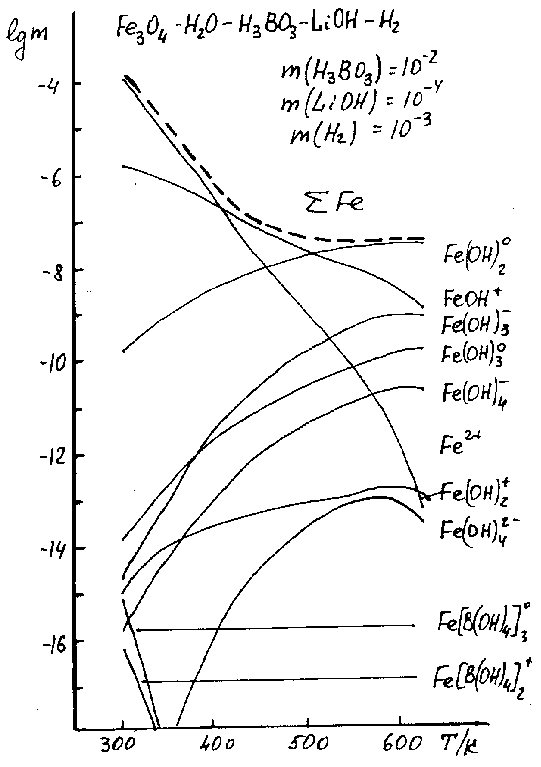
Полученные данные свидетельствуют о существенно различном, в зависимости от температуры, влиянии кислотно-основных и окислительно-восстановительных условий среды на растворимость. Так, добавление в систему борной кислоты приводит (рис.1) к практически эквивалентному росту растворимости в области низких и умеренных температур. В высокотемпературной (>200С) зоне это влияние значительно слабее и сводится практически к нулю в экстремальной (350С) точке. Более контрастно влияние гидроксида лития. Введение его в раствор приводит к существенному падению растворимости в низкотемпературной области, причем эффект этот с ростом температуры сначала заметно усиливается, достигая максимума при ~100С (рис.1). При ее дальнейшем повышении влияние добавок гидроксида лития достаточно быстро ослабевает, а в зоне 300-350С картина уже обратная — растворимость магнетита при добавлении щелочи растет. Иное воздействие на исследуемую систему оказывает восстановитель — водород. Добавление его в раствор повышает растворимость во всей области температур, причем, в отличие от кислотно-щелочных добавок, в высокотемпературной зоне это воздействие более сильное, нежели в низкотемпературной (рис.1). При детальном рассмотрении оказывается, что вообще влияние окислительно-восстановительных условий среды на растворимость магнетита значительно сложнее и неоднозначнее. Достаточно сравнить температурную зависимость растворимости в окислительных условиях с соответствующими кривыми в восстановительных (рис.1): ни в качественном, ни в количественном отношениях они не имеют ничего общего. Объяснить эти зависимости и вскрыть механизмы протекания процессов в системе позволяют полученные данные по детальному химическому составу растворов — рассматривая соединения как связанные (рис.2), так и не связанные (рис.3) с растворенным железом. Рисунок 2. Влияние температуры на комплексообразование железа в растворе.
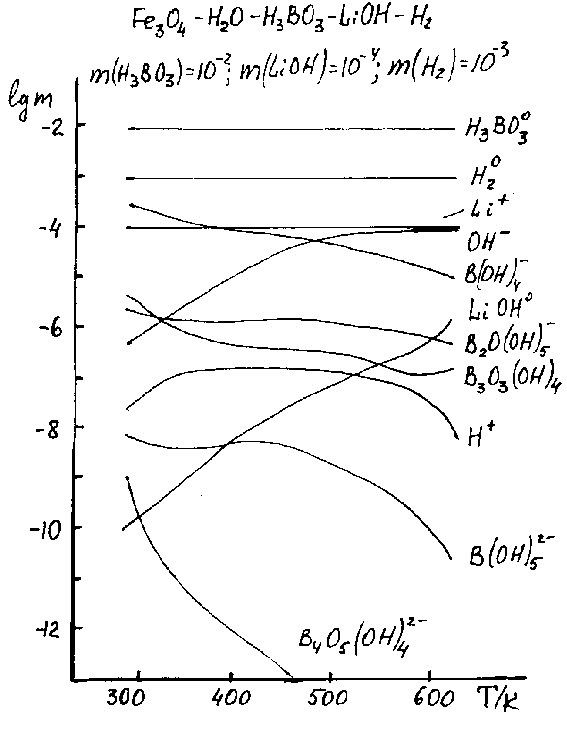
Рисунок 3. Влияние температуры на химию компонентов раствора.
Получено, что независимо от величины окислительно-восстановительного потенциала (ОВП) наблюдается его своеобразная термическая релаксация — и в кислород- и в водородсодержащих растворах наблюдается термическое ослабление их (соответственно) окислительных и восстановительных (рис.2) свойств. Другим характерным свойством системы является температурный рост гидролиза ионов железа(II) — от практически полного его отсутствия при низких температурах, до полной закомплексованности (по второй ступени) — при высоких (рис.2). Трехвалентное же железо практически полностью гидролизовано (в основном, до третьей ступени) уже при комнатных температурах и термический фактор существенно на этом процессе не сказывается (рис.2). Следует также отметить термическую неустойчивость более сложных — боратных (рис.2) и аммиачных (для борнокалиевой системы) — комплексов железа(III) и железа(II) соответственно. Весьма характерно поведение борной кислоты и гидроксида лития в растворе — для них обоих процессы диссоциации заметно ослабевают с ростом температуры (рис.3). Но если для LiOH это означает усиление гидролиза, то для H3BO3 — ослабление. При этом глубина гидролиза и полимеризация кислоты очень незначительны и падают с ростом температуры (рис.3). Сопоставление и анализ этих и ряда других результатов исследования позволяет заключить, что отмеченные явления имеет более общий и универсальный характер: рост температуры преимущественно способствует повышению устойчивости молекулярных (нейтральных) соединений в растворе и снижению продуктов их диссоциации и ионизации — ионных химических форм (рис.2, 3). Этот вывод объясняет и другую особенность — тенденцию усиления основных свойств среды с ростом температуры (рис.3): главной причиной этого является термическая устойчивость растворов борной кислоты, т.е. температурное снижение ее кислотных свойств. Получены также соответствующие результаты по влиянию и остальных параметров состояния (концентраций компонентов) на характер физико-химических взаимодействий в растворе. Особый интерес представляет случай смены ОВП среды с восстановительного на окислительный, когда, как показано, происходит и смена фазового состояния системы — вместо магнетита Fe3O4 формируется гематит Fe2O3 (рис.4). Причем, как показали результаты моделирования, термически более устойчивой фазой в рассматриваемых условиях опять-таки оказывается магнетит — при фиксированном содержании окислителя с ростом температуры первоначально стабильный гематит переходит в (более устойчивый) магнетит. Условия и температура перехода определяются количеством растворенного кислорода. Например, для данных рис.4, когда [O2]=160 мкг/кгH2O (регламентируемая концентрация), — точка перехода ~250C. Рисунок 4.
И наоборот (что практически очень актуально) — результаты исследования позволяют по заданной температуре определять минимально необходимое содержание окислителя, необходимое для трансформации магнетита в гематит (с ростом температуры соответствующая «пороговая» концентрация кислорода снижается). Поэтому радиолиз растворов или возможные «проскоки» кислорода в восстановительном ВХР, ведущие к трансформации Fe2O3 в Fe3O4, как следствие, усиливают процессы коррозии, массопереноса ПК. Последующая «релаксация» системы к восстановительным условиям (когда устойчивым снова становится Fe3O4) сопровождается осаждением растворенных ПК — в первую очередь, на твэлах, поскольку в высокотемпературной зоне растворимость Fe2O3 существенно выше Fe3O4 (рис.4). Выводы: | |
| 1 | Исследование химизма Вашего процесса и предоставление информации обо всех фазовых и химических превращениях. |
| 2 | Изучение степени влияния различных параметров (давление, температура, концентрация, химический состав) на процесс. |
| 3 | Оптимизация процесса по необходимым параметрам. |
| 4 | Разработка новых технологических процессов. |
Задать вопрос
Статьи
- Полный список статей
- Оптимизация технологических процессов
- Метод многокритериальной оптимизации технологического процесса
- Математические методы оптимизации технологических процессов
- Термодинамическое моделирование (Термодинамический расчет)
- Компьютерное (математическое) моделирование химических процессов
- Расчет продуктов химических реакций